

幽门螺旋杆菌(Helicobacterpylori,H.pylori)是消化道常见的慢性感染性细菌之一,主要定植于胃肠道,是螺旋状、微需氧的革兰阴性菌。
目前认为H.pylori感染在心脑血管疾病、呼吸系统疾病、血液系统疾病、营养代谢性疾病、泌尿生殖系统疾病、皮肤病等多种疾病的发生发展中可能起着一定的作用,甚至有学者认为H.pylori感染是一个“系统性”的疾病。
对H.pylori的研究已经持续了近三十年,H.pylori的感染与文化、年龄、地理因素、社会经济、生活方式等多种因素密切相关,尤其在发展中国家H.pylori感染率较高。人群感染H.pylori之后,不能被自然清除,感染可在体内持续数十年,甚至终身。
H.pylori感染是导致胃和十二指肠相关疾病的主要原因,流行病学和临床研究证明H.pylori感染是引起慢性胃炎、消化性溃疡疾病、胃黏膜相关淋巴组织淋巴瘤等胃肠类疾病的重要原因。
同时H.pylori感染也可能与消化系统以外疾病相关,如特发性血小板减少性紫癜,缺铁性贫血以及过敏性疾病等。因此,临床上对于H.pylori感染的治疗就十分必要。H.pylori引起胃肠内外疾病的机制目前还不清楚,但文献报道细菌特异性致病因子、导致的宿主免疫反应以及环境因素与胃肠内外疾病的进程有关。
 广告胆小者勿入!五四三二一...恐怖的躲猫猫游戏现在开始!
×
广告胆小者勿入!五四三二一...恐怖的躲猫猫游戏现在开始!
×
慢性炎症可能是H.pylori与肾脏疾病相关的机制之一,各种炎性介质导致肾内血管内皮结构损伤,最终出现微量蛋白尿等肾脏损害。H.pylori可能是导致肾内血管内皮功能障碍的病因之一,在蛋白尿发生过程中起重要作用。
有研究显示H.pylori感染后,诱导编码各种促炎性细胞因子、趋化因子、炎症调节剂和生长因子等相关基因表达,导致全身炎症性微环境状态。同时,H.pylori感染后机体释放的各种炎性介质和血管活性物质,如CRP,TNF-α,IL-1,IL-6,IL-8,HSP等物质可致局部性或全身性免疫反应,进一步加重全身微血管损害。
有研究表明在胃粘膜H.pylori感染患者高敏CRP呈高表达,而高水平CRP是慢性肾脏病发展的危险因素之一,CRP增加可导致尿蛋白排泄率的增加。TNF-α可诱导血管内皮粘附分子表达,最终致肾小球系膜细胞、内皮细胞、平滑肌细胞增殖。
此外,H.pylori感染后,通过p38MAPK/ATF-2信号通路激活环氧合酶-2过度表达,加重炎症反应。H.pylori是一种革兰氏阴性微需氧细菌,这种细菌定植于人的胃黏膜。它一般不侵入胃十二指肠组织。
 广告从秘书起步,十年内无人超越,以一己之力力挽狂澜成就一段传奇
×
广告从秘书起步,十年内无人超越,以一己之力力挽狂澜成就一段传奇
×
H.pylori感染与地理因素、文化、年龄、社会因素等相关。H.pylori感染是一种非常普遍的慢性感染,在全球自然人群中的感染率较高,各地差异非常大,发展中国家高于发达国家。在我国以及亚太地区H.pylori感染率都较高,并且感染可在体内持续数十年甚至终身。
2001至2004年我国特大范围H.pylori流行病学的调查显示,中国自然人群H.pylori感染率约54.76%。现症感染率为42%~84.62%。现已公认,H.pylori与慢性胃炎、消化性溃疡、MALT淋巴瘤、胃癌的发病等存在密切关系。
同时与多种胃肠外疾病的发展如肾相关性疾病也密不可分。H.pylori通过其毒素例如CagA、VacA,或其他酶类导致胃粘膜损害及全身病变。有研究提示幽H.pylori感染后,可诱导编码各种促炎性细胞因子、趋化因子、炎症调节剂和生长因子的基因的表达,创造了全身炎症的微环境状态。
H.pylori释放的各种炎性介质和血管活性物质,例如CRP、IL-1、IL-6、IL-8、TNF-α、HSP、PAF等多种物质,这些介质导致局部及全身的免疫反应,各种炎症介质可导致微血管损害。
有研究提示高敏的CRP在胃粘膜H.pylori感染中表达增高,高水平的CRP是慢性肾脏病发展的危险因素,其增加可导致各种炎症介质的增加从而引起尿蛋白排泄率的增加。
肾小球血管内皮在TNF-α的作用之下,粘附分子的表达增加,同时影响凝血因子及血小板源生长因子,最终可导致内皮细胞、平滑肌细胞、肾小球系膜细胞的增殖。此外,而H.pylori感染后,环氧合酶的过度表达,在炎症中又起着重要作用。
H.pylori可以通过p38MAPK/ATF-2信号通路激活环氧合酶-2的表达。由H.pylori引起的炎症反应对肾脏损伤有重要促进作用。此外,研究提示正常人群中长期慢性H.pylori感染后其低密度脂蛋白较高,而在H.pylori的慢性感染或急性感染期间,出现了血白细胞、转氨酶、低密度脂蛋白、高密度脂蛋白等多项血清学指标的变化。
H.pylori感染后可使患者出现的一系列消化道症状,感染伴随的胃泌素的增加,胃排空延迟,严重的消化道症状或萎缩性胃炎等均可能出现叶酸、维生素B12吸收下降,同时伴随着同型半胱氨酸这种含硫氨基酸的增多,同型半胱氨酸通过降低腺苷酸环、氧化应激、产生大量氧自由基等多种途径最终造成血管内皮的损伤,引起和促进肾脏损害。
研究提示,在纳入的243例健康体检人中的H.pylori感染率为44%,同时经过肾穿刺确诊为膜性肾病患者总共32例,其中H.pylori感染率为66%,明显较对照组高。同时针对部分H.pylori阳性的患者进行H.pylori的三联疗法进行根治,4例患者复查提示根治成功,4例患者中的3例患者尿蛋白有所下降。
在另一研究中,通过免疫组织化学方法,在膜性肾病、IgA肾病及局灶性节段性进行调查研究,通过使用快速粪便抗原试验,检测患者H.pylori感染情况,同时,对于H.pylori阳新患者,进行规范Hp三联疗法进行根治。
对于19例Hp阳性的膜性肾病患者,根治后尿蛋白有所下降,并且具有统计学意义,在10例H.pylori阳性的IgA肾病患者根治后,其尿蛋白有所下降,但无统计学意义,对于FSGS(局灶性节段性肾小球硬化)组,蛋白尿有所上升,但无统计学意义。
说明H.pylori的感染对于膜性肾病有一定作用,对于IgA肾病患者而言,虽有所下降,但无统计学意义,可能原因为标本量过少导致。目前认为感染与肾病发生的关系可能为H.pylori介导的异常免疫反应所致,如产生循环抗原或H.pylori类似抗原等。
IgA肾病是常见原发性肾小球肾炎,其致病机制目前暂不清楚,但低糖基化IgA1的形成与增多,被认为是最主要IgA肾病的发病机制。近年,越来越多的研究报道提示,H.pylori感染可以促进IgA肾病的发生。
通过13C尿素呼气试验检测IgA肾病患者与对照组相比,发现两者的H.pylori感染率相同,但IgA肾病患者血清中抗Hp-IgA抗体的阳性率及抗体反应强度均显著增高,检测结果显示,几乎所有病例抗HpIgA抗体为IgAl,且超过90%的IgA为聚合型;
两组比较,血清抗Hp-IgG抗体的阳性率则没有差异,但是IgAN患者有高的抗体反应强度。该研究结果还证明,IgAN患者对由H.pylori导致的黏膜感染有过强的全身性抗体反应。
研究证实H.pylori存在于腭扁桃体,与反复扁桃体炎的对照组相比,IgA肾病组腭扁桃体H.pylori感染率更高,他们推测H.pylori与Hp-IgA抗体可以在腭扁桃体处形成免疫复合物,进入全身血液循环。
另有研究提示在粘膜H.pylori感染的IgA肾病患者中,IgA1的凝集素结合水平增高,表明粘膜的H.pylori感染可导致IgA肾病患者IgA1的低糖基化,并表明循环中这种低糖基化IgA1的增高可能是系统对黏膜抗原的异常反应。
我们实验团队研究提示IgAN感染H.pylori感染率较非IgAN患者及正常人高(待发表),体外实验证实H.pylori的毒力因子(CagA)可刺激B淋巴细胞产生低糖基化IgA,而这种低糖基化IgA1是发生IgAN原因之一。同时通过使用CagA刺激大鼠系膜细胞,增加细胞增殖和细胞外基质的形成。这都表明H.pylori与IgAN有着密切的关系。
其他类型原发性肾小球肾炎,例如膜增生性肾小球肾炎、局灶性节段性肾小球硬化,也有研究提示可在其肾脏病理切片找到H.pylori抗原,但研究较少,且与H.pylori的联系不如膜性肾病及IgA肾病密切。
糖尿病肾病的发病机制目前暂不清楚,糖尿病肾病包括(几个阶段),疾病的发生发展中,包括血糖血脂、胰岛素抵抗等多种因素参与其中。此外,炎症反应被认为在糖尿病肾病的发生发展各个阶段都起着至关重要的作用。
微量白蛋白尿目前被认为是与内皮细胞低度炎症密切相关,Ross经证实慢性系统性的炎症及血管内皮细胞功能不良是动脉粥样硬化及微量白蛋白尿的关键因素。最初是由Simon提出,发现糖尿病患者的H.pylori感染率较对照组明显增高(62%vs.21%),之后有不同的学者对此研究得到类似的答案。
一项1997年和2012年间纳入30个病例对照研究和2队列研究的荟萃分析提示,H.pylori感染与各种类型的糖尿病及糖尿病肾病存在联系,H.pylori感染是糖尿病及糖尿病肾病危险因素,其感染在整个病程中都发挥了致病作用。
虽然目前暂不确定这种因素的在疾病所占的地位,但是已经有学者证实H.pylori感染之后的长期慢性系统性炎症增加糖尿病患者血管损伤,同时增加他们发生呼吸系统、心脑血管系统疾病的易感性。
在幽门螺旋杆菌的感染过程中,过多的促炎因子的产生,释放的炎症介质与机体之间的反应引起胃部损害同时出现消化系统以外的表现。研究显示H.pylori感染对葡萄糖代谢、血脂、炎症反应等存在影响,而这些因素都是糖尿病肾病进展的危险因素。
研究表明,高密度脂蛋白,氧化剂脂质,低密度脂蛋白,血栓性激活有关的抗凝血酶(ATIII),血管假性血友病因子,肿瘤坏死因子,IL-1和IL-6等与H.pylori感染有着密切的关系。
然而遗憾的是,目前尚没有确切的证据证明H.pylori感染会导致肾脏超微血管结构的变化。近年来,在糖尿病患者中H.pylori感染得到充分的强调,目前因研究数量有限,没有明确的结果,H.pylori感染与糖尿病肾病的发生存在关联。

研究中,由细胞毒素相关geneA产生感染(CagA基因),H.pyloriCagA基因菌株的感染与内皮抗原交叉反应,这个研究被认为是糖尿病患者的该种菌株的感染与微量白蛋白尿之间的关联。
有研究提示针对2型糖尿病患者根治H.pylori之后,蛋白尿会有所降低。因此,可以认其对肾小球的损伤,可以出现尿蛋白的增加,而全身炎症的反应,血管内皮的损害是H.pylori感染相关联,这可能是糖尿病性肾病的进展的标志。

又有研究提示与糖尿病尿蛋白阴性与尿蛋白阳性患者相比,存在蛋白尿的糖尿病患者H.pylori感染率更高,且在糖尿病肾病患者中,H.pylori感染者的血清IL-8和TNF-α更高。
一些病例报告已经描述了H.pylori感染和过敏性紫癜的关系,治疗H.pylori感染导致HSP的及时解决,或H.pylori的根除可以防止HSP的复发。同时,在紫癜性肾炎、系统性红斑狼疮患者的病理组织切片中可以发现H.pylori抗原。
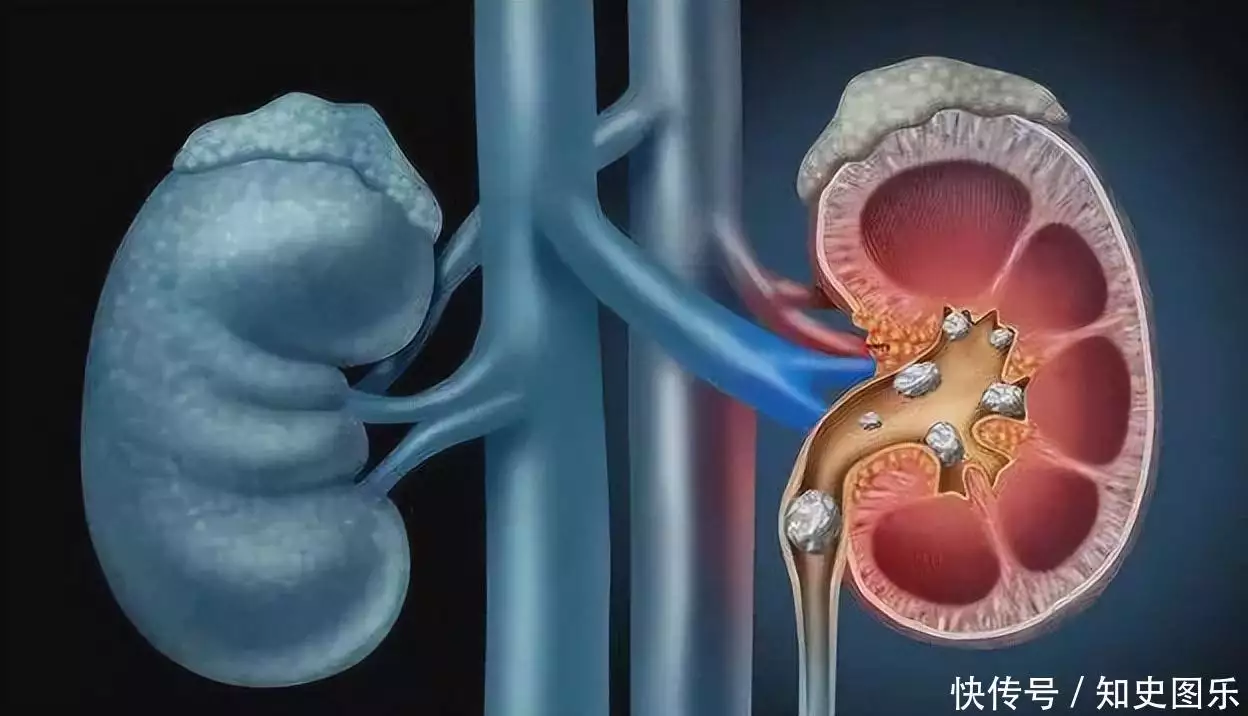
一项临床前瞻性研究纳入存在消化道症状的患者进行H.pylori检测,提示根治Hp后,可降低有消化内科就诊患者的蛋白尿水平。
另有研究提示对于糖尿病患者,给予根治H.pylori后,其蛋白尿水平会降低。
H.pylori与其他系统疾病的相关性研究越来越多,其在肾脏疾病中的作用引起大家关注,但其导致肾脏损伤机制暂不明确,仍需进一步的探究,这可能会帮助我们对疾病预防、诊断和治疗提供一个新思路。