

来源:生物世界

 撰文丨王聪
撰文丨王聪编辑丨王多鱼
排版丨水成文
胰腺癌,其最常见类型为胰腺导管腺癌(PDAC),是一类极度致命的恶性肿瘤,具有很高的死亡率,80%-85%的患者在确诊时已处于晚期或已出现转移,从而无法进行手术治疗。无法切除且已转移的晚期胰腺癌的主要临床治疗方法是化疗。然而,化疗具有显著毒性,且在改善患者生存方面效果有限。
近年来,全世界的研究人员付出了巨大努力来开发新型治疗策略和治疗组合以改善胰腺癌患者的治疗效果,但胰腺癌患者的死亡率仍然居高不下,5年生存率不足10%。
胰腺癌独特的肿瘤微环境为其治疗带来了挑战。约70%的胰腺癌患者表现出以高密度结缔组织和细胞外基质为特征的“致密”肿瘤微环境。这不仅阻碍了药物的有效递送,而且可能削弱化疗和其他治疗模式的有效性。这一微环境特征使胰腺癌成为一种难以治疗的癌症类型,迫切需要能够克服这一局限性的新药物或新策略。
2024年10月14日,中国科学院杭州医学研究所谭蔚泓院士、上海交通大学医学院附属仁济医院孙洋、徐海燕等人在 Signal Transduction and Targeted Therapy 期刊发表了题为:Aptamer-drug conjugates-loaded bacteria for pancreatic cancer synergistic therapy 的研究论文。
该研究开发了一种胰腺癌协同疗法,利用细菌负载核酸适配体-药物偶联物(ApDC),将细菌的实体瘤穿透能力和ApDC的靶向和毒性作用结合起来,实现优化的药物递送、增强治疗效果和激活靶向免疫反应,为胰腺癌的治疗提供了一种有效的协同策略。

核酸适配体(aptamer)由2009年诺贝尔生理学或医学奖获得者 Jack Szostak 命名,这是一类短的单链DNA或RNA寡核苷酸,通过形成三维空间结构,结合特定蛋白或者细胞发挥作用。
核酸适配体具有广泛的优点,包括合成简便、可定制、热稳定性好、分子小、组织穿透能力强等。这些特性使得核酸适配体成为有前途的药物类型,近年来,药物递送方法取得了重大进展,包括对核酸适配体的递送,这些进步促成了核酸适配体-药物偶联物(Aptamer-Drug Conjugates,ApDC)的发展,这是一种创新结构,巧妙地将适配体的靶向准确性与药物载荷的治疗效果结合在一起。
但需要注意的是,核酸适配体也存在一些缺点,例如被肾脏清除的风险,以及体内核酸酶的降解作用。近期的研究表明,通过修饰核酸适配体或将它们有策略地与微生物结合,可以显著延长它们在体内的存在时间并降低它们被肾脏清除的风险。但这必须考虑生物安全问题。
VNP20009是一种减毒的沙门氏菌菌株,具有独特的细胞膜穿透能力,除了对厌氧环境有明显的偏好外,还能够穿越“致密”的胰腺间质组织。之前的研究显示,它能够诱导肿瘤细胞发生凋亡和坏死,同时激发宿主免疫系统产生强效反应,从而有效地抑制肿瘤生长。然而,仅将这种细菌作为单独的肿瘤治疗方法,在临床试验中未能产生显著的肿瘤消退效果,这揭示了一个关键的局限性——对癌细胞的毒性不足和靶向效果不佳。
越来越多的证据表明,细菌疗法可以与其他治疗方式协同作用。同时,出色的穿透能力和生物安全性使得细菌成为实体瘤治疗领域基于核酸的药物递送的有吸引力的候选者。
为了克服胰腺癌治疗中的重大挑战,研究团队提出了一种新型协同疗法,结合了细菌和核酸适配体-药物偶联物(ApDC)的优势,采用简单直接的“点击化学”方法,将ApDC通过共价键附着在VNP20009的表面,构建了VNP@ApDC,从而将细菌的穿透能力和ApDC的靶向和毒性作用结合起来。
这种创新策略充分利用了这两种治疗剂的优势:ApDC可以增强细菌在肿瘤微环境中的定植,而VNP20009则显著提高了ApDC的稳定性,并有助于其有效穿透致密的肿瘤间质。这种互惠关系确保治疗剂能够更有效地到达肿瘤部位并保持稳定,从而实现优化的药物递送、增强治疗效果和激活靶向免疫反应。
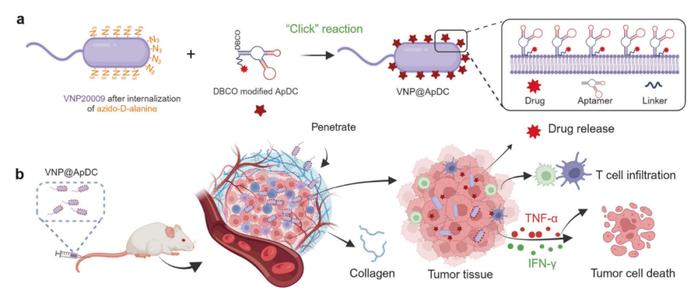
具体来说,通过该策略,VNP20009通过厌氧趋化特异性靶向胰腺癌肿瘤组织(肿瘤组织表现出缺氧环境),并在核酸适配体的特异性结合驱动下粘附于肿瘤细胞。结果表明,与游离药物组相比,该组合方法可延长ApDC的血清稳定性至48小时,并导致肿瘤部位的药物浓度增加。此外,核酸适配体与癌细胞的靶向结合使肿瘤部位的VNP20009定植增加了3倍,导致肿瘤细胞死亡和T细胞浸润增加。值得注意的是,通过整合化疗和免疫治疗,能够进一步显著增强治疗效果,并在各种动物模型中显示出一致的结果。
综上所述,该策略利用了细菌和ApDC的优势,开发出了双重功能疗法,为胰腺癌的治疗提供了一种有效的协同策略。
论文链接:
https://www.nature.com/articles/s41392-024-01973-3
