

嗜酸性实性和囊性肾细胞癌(ESC-RCC)是一种新的、不常见的肾细胞癌类型,在WHO 2022年肾肿瘤分类中被确认并作为一个独立的实体引入。ESC-RCC以前被称为“未分类肾癌”,后来被称为“结节性硬化症(TSC)相关性肾癌”,现在是一个独特的肾脏肿瘤类别,有自己的名称,特定的临床表现,以及独特的形态学、免疫组织化学和分子谱。ESC-RCC的诊断是一个复杂的挑战,且易被误诊。诊断这种肿瘤在于病理学家的知识,并通过研究使其数据保持更新,从而限制使用过时的命名法。本文报道1例与已有病例相比有一些特殊性的病例,旨在加深对本病的认识,并丰富文献。
研究背景
WHO 2022年肾肿瘤分类引入了一种新的罕见类型的肾细胞癌(RCC),称为嗜酸性实性和囊性肾细胞癌(ESC-RCC)。由于该疾病是最近才出现的,而且文献中对大约70例病例的描述有限,因此该疾病仍然是一个复杂的挑战,可能经常被误诊或未得到充分利用。ESC-RCC具有惰性生物学行为和低转移潜能的特点,因此与其他类型的肾肿瘤鉴别至关重要。为了全面确定ESC-RCC的生物学行为,需要进一步的研究,因为目前只有有限数量的充分记录的病例系列。
本文报告了一名58岁男性左肾散发性ESC-RCC的病例,并总结了现有的文献,包括临床、病理、免疫组织化学和分子数据,以提高我们对这种肿瘤的认识并减少诊断的不准确性。据研究者所知,这是罗马尼亚和东欧文献中报道的首例病例。
研究者以病例为基础的文献综述的目的是强调ESC-RCC从一种未分类的肾癌转变为一种明确定义的实体,评估所有讨论这类肿瘤的文献,并提出了在该病理科诊断的一例ESC-RCC。
研究结果
案例展现:
研究报告了罗马尼亚特尔古穆列什临床郡医院(Târgu-Mureș Clinical County Hospital)泌尿外科收治的一名58岁男性患者,患者肉眼血尿,影像学检查发现左肾有肿瘤。患者患动脉性高血压,无其他重要病史,入院时健康状况良好。患者行左侧腹腔镜根治性肾切除术,并将标本送病理科做组织病理学检查和最终诊断。从宏观上看,肿瘤边界较清楚,无包膜,内含明显坏死和出血,最大直径约12 cm。镜下,肿瘤呈实性、囊性,偶尔呈乳头状(图1A-C)。
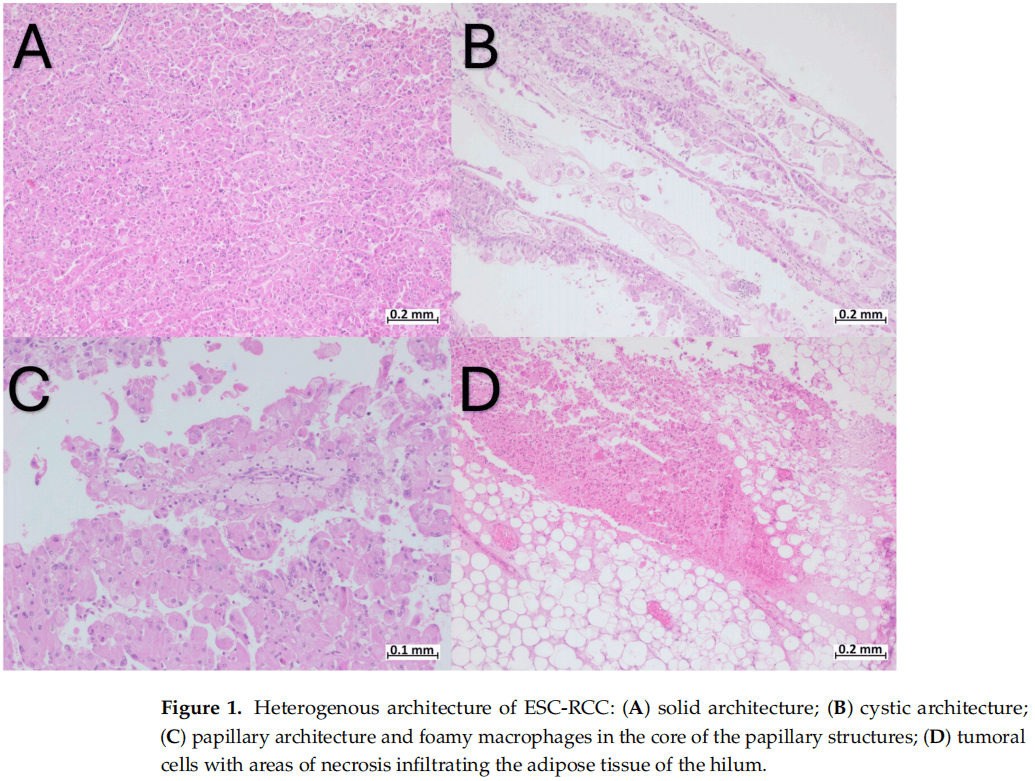
图1
肿瘤细胞呈多角形,胞质丰富,嗜酸性,细胞核圆形至卵圆形,多形性中等,可见核仁(图2)。局灶性观察到双核细胞,肿瘤细胞显示胞质内空泡和小簇嗜碱性颗粒(图2)。囊性结构由单层细胞内衬,呈“鞋钉”外观(图2D)。在乳头结构的核心内,观察到成组的泡沫状巨噬细胞(图1C)。显微镜检查发现明显的出血和肿瘤坏死区域。肿瘤浸润肾门的脂肪组织(图1D),未浸润肾周脂肪组织。未见淋巴管和血管侵犯。肿瘤邻近肾实质表现为肾小球玻璃样变,肾小管甲状腺化。肝门部2枚淋巴结未见转移。
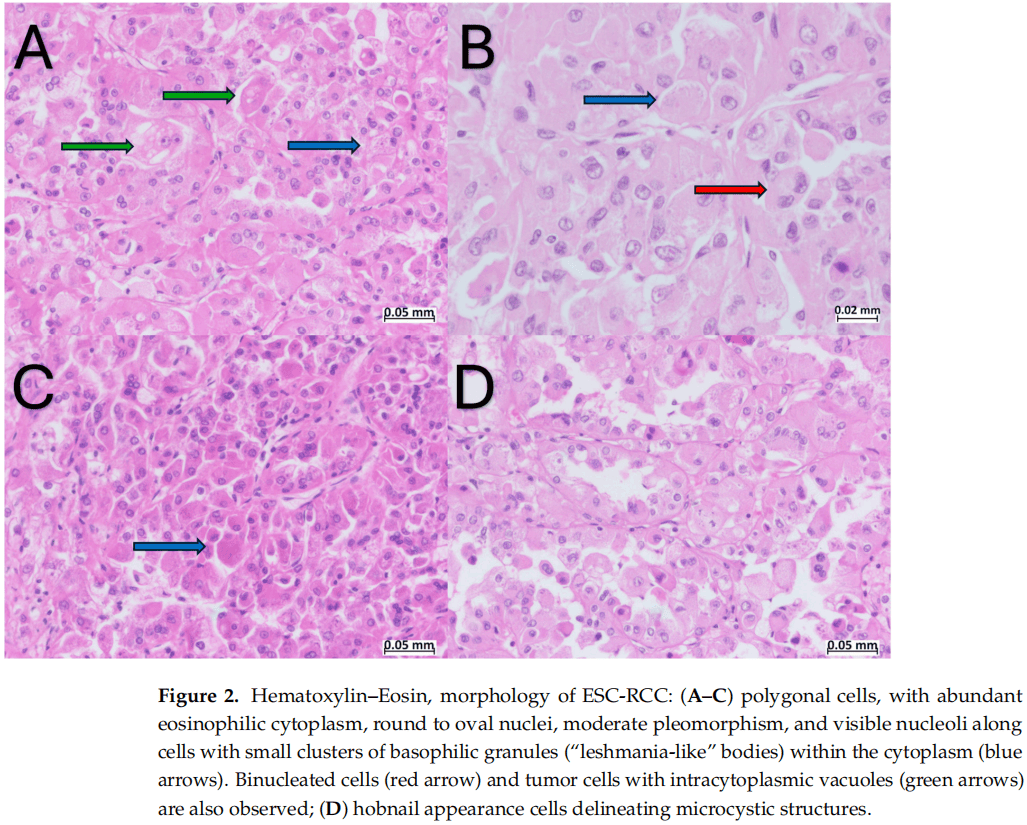
图2
肿瘤细胞PAX8阳性,CK20、CKAE1/AE3、CD10和AMACR弱阳性和局灶阳性(图3),CK7、CD117、MelanA、HMB45、TFE3、Actin和ALK阴性(图4)。FH和SDHB的表达保留。
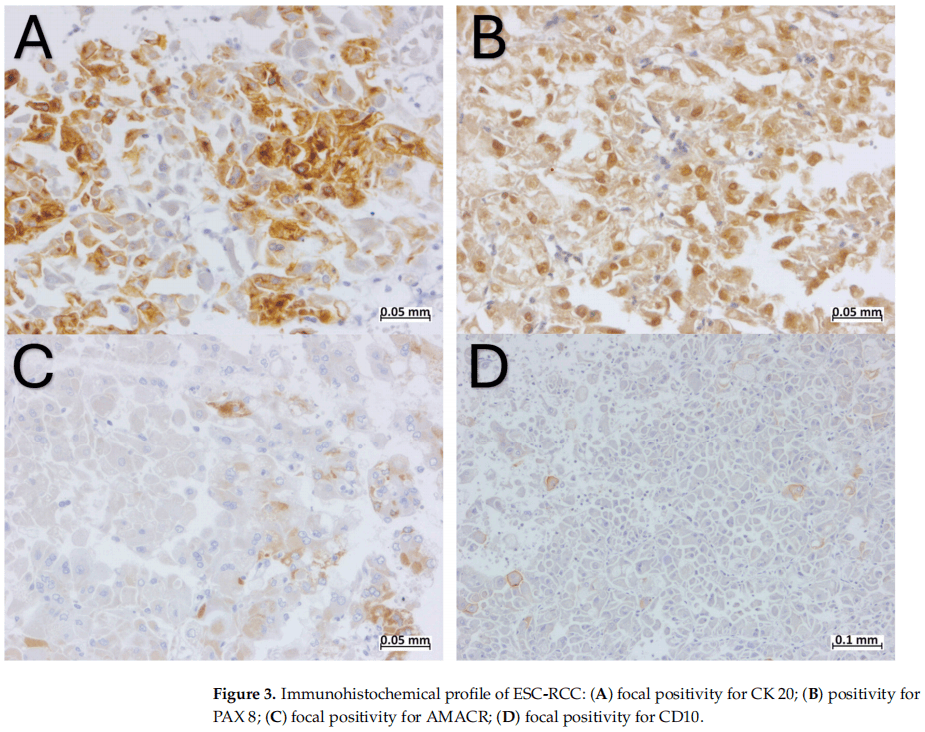
图3
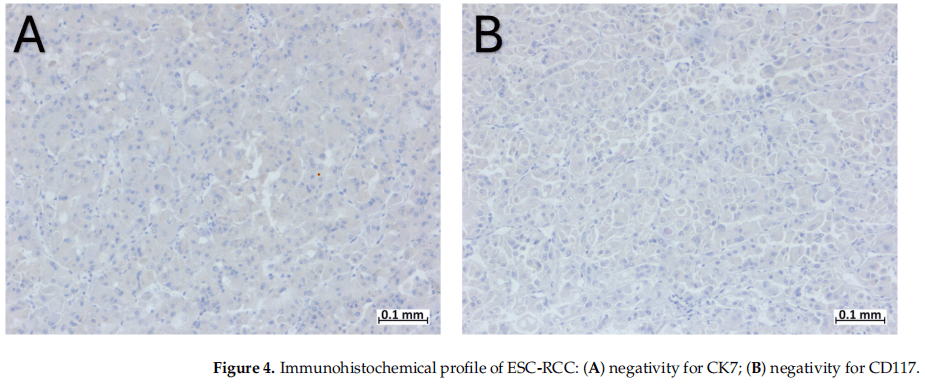
图4
一项补充的分子研究发现了TSC1和JAK1的突变,证实了ESC-RCC的假设。表1总结了该病例的基因变异。由于肿瘤侵犯肝门脂肪组织,肿瘤最终分期为pT3a期。
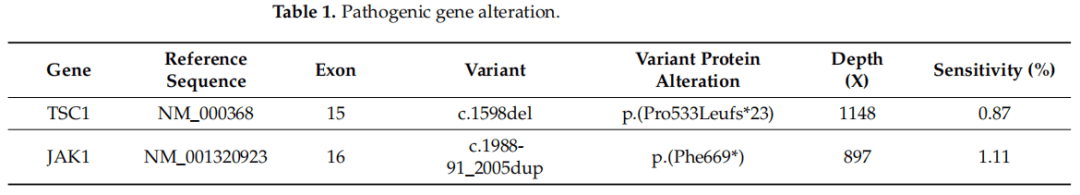
表1
病例在多学科团队(MDT)中讨论,并由主要成员决定“等待观察”策略。术后10个月,患者无病生存。
ESC-RCC从未分类到独特类型的肿瘤:
近年来,由于分子病理学的进步,对肾肿瘤的认识有了明显的进步。在对临床特征、形态学、免疫组织化学和基因突变进行全面检查后,许多新的肿瘤被发现,现有的肿瘤被重新分类。嗜酸细胞性肾肿瘤以前被归类为未分类,现在由于其显著的预后意义和临床相关性而成为一个独特的诊断类别。
与结节性硬化症(TSC)相关的肾细胞癌(RCCs)最早于1996年被记录。随后,3个更广泛的现代系列文献一致表明,TSC相关RCCs表现在更年轻的年龄,主要影响女性(7:3的比例),通常表现为多灶性或双侧。2014年,两组研究人员提出了一系列重要的TSC相关RCCs,为目前的分类系统奠定了基础。Yang等人在19例TSC患者中记录了46个肿瘤,并按照以下方式进行分类:(1)乳头状RCC(52%),(2)杂合性嗜酸细胞性嫌色细胞瘤(33%)和(3)未分类的RCC(15%)。第二项研究由Guo及其同事进行,他们检查了18例TSC患者的57个RCCs,将其分为以下几种:(1)肾血管平滑肌腺瘤瘤(30%),(2)嫌色细胞样肾细胞癌(59%),(3)颗粒嗜酸性/大囊性肾细胞癌(11%)。尽管这两项研究之间的命名法有所不同,但他们记录了相似的形态学和免疫组织化学模式,这些模式导致多年来一些文献描述了TSC/mTOR通路突变的散发病例中的类似肿瘤。因此,ESC-RCC的概念早在当时就被提及,作为与TSC相关的三种肾肿瘤之一,但在Yang的研究中,它最初被确定为“未分类”,在Guo的研究中被确定为“颗粒状嗜酸性/大囊性肾细胞癌”。
目前,诊断为TSC的患者表现出的肿瘤主要分为四类:(1)具有平滑肌瘤样间质的RCC(RCC-LMS),(2)嗜酸性实性和囊性RCC(ESC-RCC),(3)低级别嗜酸细胞肿瘤(LOT),(4)嗜酸性空泡性肿瘤(EVT)。
随后,在2016年,Trpkov等人描述了一种独特的散发性肿瘤,好发于女性,惰性进展,具有独特的组织病理学特征,形态学上与之前确定的发生于TSC患者的颗粒状嗜酸性大囊性RCC相似。因此,Trpkov引入了术语嗜酸性实性和囊性肾细胞癌(ESC-RCC)来描述他们发现的肿瘤,这种肿瘤在临床环境中偶尔出现在没有TSC诊断的患者中。自该报告发表以来,在不同的研究中又报道了更多的散发性ESC-RCC病例,在所有肾细胞癌中估计发病率为0.07%~0.2%。
近期研究发现,TSC和ESC-RCC很少同时发生,只有约10%的ESC-RCC患者同时出现TSC的临床症状。WHO去年在最新版中引入了这一命名法,认识到这种罕见的病理是一种具有可区分的组织病理特征的独特肿瘤。
病因学、流行病学和临床表现:
ESC-RCC的确切病因尚不完全清楚。然而,已知这种肿瘤以前被认为主要发生于结节性硬化症(TSC)患者。结节性硬化症是一种影响多个器官的综合征,如皮肤、脑、心脏、肺或肾,有2-4%的几率发展为肾癌。TSC是一种常染色体显性遗传病,全球约有200万人患病。TSC是由位于染色体9q34的TSC1或位于染色体16p13.3的TSC2的胚系功能缺失突变引起。大约70%的TSC患者存在TSC2突变,与TSC1突变相比,TSC2突变通常与更高的疾病负荷和严重程度相关。基因TSC1和TSC2与TBC1D7构成一个复合体,管理mTOR复合体1的功能。这两个基因的失活消除了mTORc1的下调,导致细胞生长和肿瘤发生的增加;因此,该通路的失调可能参与了ESC-RCC的发生和发展。
ESC-RCC最初被识别为颗粒状嗜酸性、大囊性或未分类的肾癌,约占所有与TSC相关的肾上皮肿瘤的7-11%;然而,大多数病例是散发的。虽然尚未确定具体的关联,但某些环境暴露或生活方式因素可能促进ESC-RCC的发生。一般而言,ESC-RCC的发生可能是基因、分子和环境因素之间复杂的相互作用的结果。需要进行更多的研究来完全理解驱动这种罕见类型肾细胞癌出现的潜在机制。
ESC-RCCs通常表现为孤立性、小体积、低分期肿瘤,文献报道的多灶性和双侧病例很少,且主要发生于女性。发病年龄范围广,儿童患者较多,平均年龄57岁。目前的发病率尚不清楚,因为许多病例之前由于缺乏命名法,被归类为“未分类的肾细胞癌”或其他疾病。临床症状通常缺乏,肿瘤可能是在与肿瘤无关的影像学检查中偶然发现的。
组织病理学,免疫组织化学和分子病理学:
组织病理学特征:
特定的形态学特征和系统的免疫组化谱通常可为ESC-RCC的诊断提供足够的标准。宏观上,ESC-RCC典型表现为界限明确、无包膜的肿瘤,大体表现为实性和囊性生长。大囊肿的存在是一个突出的肉眼特征,尽管偶尔也只观察到显微镜下的囊肿。大多数记录在案的肿瘤体积较小,平均为4.2 cm。然而,报道的肿瘤大小具有可变性,如Trpkov等报道的最大系列所示,最大尺寸从1.2 cm到13.5 cm不等。
镜下,肿瘤边界清楚,周围无形态良好的纤维包膜。实性区域呈弥漫性、腺泡性或巢状生长。肿瘤细胞呈丰富的嗜酸性颗粒状细胞质,含有粗嗜碱性颗粒(称为“点彩”或“利什曼病样”小体)。这些颗粒代表粗面内质网的聚集,如电子显微镜所示。囊腔内可见鞋钉状排列的细胞。细胞核呈圆形或卵圆形,核仁不明显,类似于WHO/ISUP分级2或3级。可见沙砾体、多核细胞簇、小群泡沫状巨噬细胞和淋巴细胞。此外,局灶性乳头状结构或其他形态变化,如透明细胞特征或管状生长也有描述。微囊区或大囊区通常内衬有鞋钉样外观的细胞。在最近的一项研究中,在一例ESC-RCC中发现了黑色素。
免疫组织化学特征:
ESC-RCC最特异的免疫组化特征包括细胞角蛋白20(CK20)阳性染色和细胞角蛋白7(CK7)阴性染色。ESC-RCC可表现为CK7弱阳性,约10-15%的病例中,CK20可为阴性,当CK7呈强阳性和弥漫阳性而CK20为阴性时,则排除了ESC-RCC诊断的可能性。ESC-RCC的免疫组化谱还包括CK AE1/AE3、CK 8/18、Vimentin、AMACR和PAX 8阳性染色,CD117、CD10和CA IX阴性。Sharma等报道了1例局灶性CD117阳性的病例,位于嗜酸细胞瘤样特征区域。在本研究的病例中,CD10局灶阳性,这一发现与Trpkov等的研究一致,在Trpkov等的研究中,77%的病例CD10局灶阳性。黑色素细胞标志物(Cathepsin-K,HMB45和Melan-A)阳性在ESC-RCC中是一个独特的发现。与之前的研究报道的HMB45相比,Cathepsin-K和Melan-A的表达似乎更常见。ESC-RCC完整的免疫组化特征见表2。
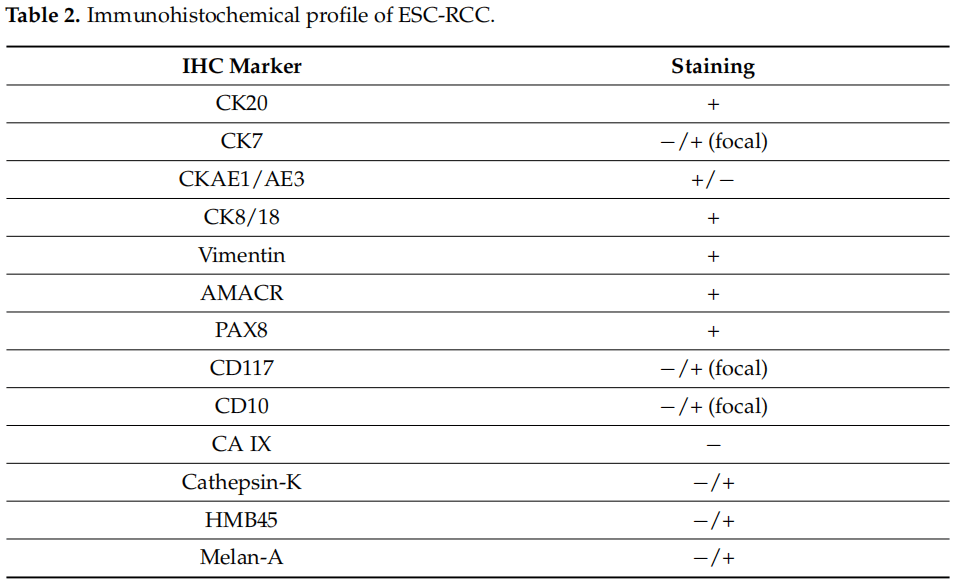
表2
分子特征:
使用二代测序(NGS)对散发性ESC-RCC进行分子分析,发现了TSC基因的体细胞双等位基因突变,特别是在绝大多数病例中的TSC1和TSC2。在散发病例的背景下,ESC-RCC表现出偏好女性,并且与变异TSC1或TSC2基因的双等位基因丢失或突变相关。在Mehra等进行的一项研究中,7例散发性ESC-RCC中有6例出现TSC1或TSC2双等位基因缺失,从而得出结论,TSC突变在ESC-RCC的发生中具有重要意义。在其他研究中,Palsgrove等和Munari等也发现在100%的散发性ESC-RCC病例中存在TSC1或TSC2突变。ESC-RCC携带TSC1或TSC2突变,反复发生的相互排斥的TSC1/2体细胞双等位基因缺失被认为是ESC-RCC的分子标志物。在匹配的非肿瘤性肾实质中无胚系TSC异常可作为ESC-RCC和其综合征型对应物(TSC-RCC)的区分因素。在一项研究中,Munari等利用二代测序技术对ESC-RCC进行了多区域的肿瘤取样。他们确定在所有分析的肿瘤样本中均存在TSC1突变,证实了其克隆起源。这一发现为ESC-RCC中TSC基因功能障碍的一致发生提供了额外的支持。Palsgrove等人还证实了儿童ESC-RCC(88%的病例)和成人ESC-RCC(100%的病例)中TSC1或TSC2基因突变的一致发生。这一观察包括一个转移性ESC-RCC病例,该病例对靶向mTOR治疗显示出完全应答。TSC1和TSC2基因的突变会抑制mTOR复合体,导致mTORC1的激活,进而导致参与细胞增殖和生长的下游细胞通路失调。Trpkov等对ESC-RCC进行的分子核型分析揭示了频繁和反复的基因组变异。结果表明,该肿瘤可能存在染色体16、7、13q和19p的拷贝数扩增,以及Xp11.21和22q11.23的拷贝数缺失,以及TSC1和TSC2的杂合性缺失。
虽然这些分子变化不是ESC-RCC独有的或特异性的,但当考虑到ESC-RCC特有的形态学和免疫组化特征时,它们表明了一个相对明确的形态-分子实体。
鉴别诊断:
考虑到不同肾脏肿瘤的不同治疗方法和预后意义,区分ESC-RCC与其他RCCs非常重要。这一区别尤其关键,因为不同类型的肾肿瘤有不同的治疗策略和预后,从而确保最佳的患者管理。
首先,在ESC-RCC的鉴别诊断中,应考虑到以嗜酸性细胞为特征的肾肿瘤的全面范围。这类肾细胞癌包括肾嗜酸细胞瘤(RO)、嗜酸变异型嫌色性肾细胞癌(Chr-RCC),以及一些较少见的疾病,如琥珀酸脱氢酶(SDH)缺陷性RCC、MiTF易位性RCC(尤其是TFEB)和上皮样血管平滑肌脂肪瘤(AML)。
其次,TSC相关RCCs分为4种原发性肿瘤类型:ESC-RCC、伴有平滑肌瘤样间质的肾细胞癌(RCC-LMS)、低级别嗜酸细胞性肿瘤(LOT)和嗜酸细胞空泡性肿瘤(EVT)。因此,ESC-RCC应与其他TSC相关RCCs进行鉴别诊断。三种新发现的肾肿瘤(ESC-RCC、LOT和EVT)均具有独特的形态学、相对统一的免疫表型和特定的分子基因学特征。LOT和EVT为嗜酸细胞肿瘤,胞质内有丰富而明显的线粒体;ESC-RCC为嗜酸性肿瘤,有丰富的嗜酸性细胞质,但无嗜酸细胞的细胞质。顾名思义,EVT(以前称为高级别嗜酸细胞瘤-HOT)表现为高级别形态学,丰富的嗜酸性细胞质,突出的胞浆内空泡,与ESC-RCC容易区分。在罕见的ESC-RCC病例中,可能观察到散发性空泡,但通常不存在厚壁血管(EVT的特征)。虽然免疫组织化学可以提供一些指导,但值得注意的是,ESC-RCC可能偶尔检测到CK20阴性,而EVT可能很少在单个细胞中显示CK20阳性。LOT的特征是细胞均一性和CK7+/CD117 -免疫表型,而ESC-RCC缺乏细胞均一性。在这种情况下,鉴于两者的免疫表型相似,鉴别诊断的主要依据是形态学特征。值得注意的是,ESC-RCC、EVT和LOT可以在同一肾脏内共存,这并不意外,因为这三种肿瘤具有共同的基因驱动因素。在一例TSC患者中记录了这样一个显著的发现。RCC-LMS的特征是平滑肌间质(肌动蛋白阳性),它将肿瘤细胞(CK7阳性)分离成边界清楚的肿瘤结节。间变性淋巴瘤激酶重排相关性肾细胞癌(ALK-RCC)的大体特征(实性和囊性外观)以及镜下异质性表现为不同的结构和细胞形态,包括实性和囊性结构,肿瘤细胞胞质嗜酸性和胞质内空泡,需要考虑到ALK-RCC的鉴别诊断。
然而,ESC-RCC的特定形态学(特别是实性和囊性结构、丰富的嗜酸性细胞质和胞质内嗜碱性颗粒)结合特异性免疫组织化学特征(CK20+/CK7-)应该足以准确确立诊断。
在表3中,研究者总结了ESC-RCC和嗜酸细胞/嗜酸细胞性肾肿瘤的主要形态学差异,而关于免疫表型的主要鉴别诊断见表4。
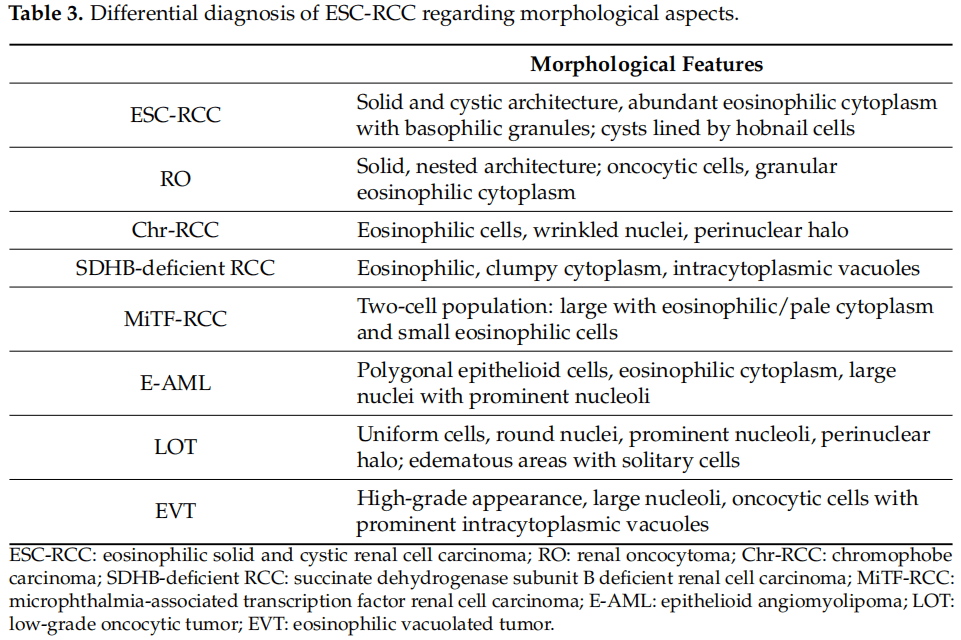
表3
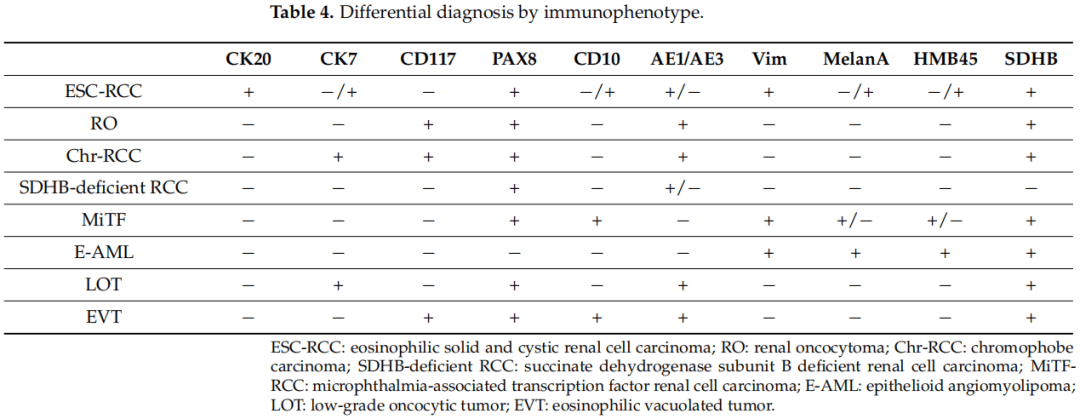
表4
治疗和预后:
ESC-RCC治疗的金标准仍是手术切除,根据肿瘤分期,选择肾部分切除术或根治性切除术。ESC-RCC携带TSC1或TSC2突变,反复发生相互排斥的体细胞双等位基因TSC1/2缺失,导致mTORC1信号过度活跃。最近,Tjota等强调与TSC/MTOR相关的肿瘤形成了一个独特的群体,具有不同的形态、免疫组织化学染色和临床行为。幸运的是,目前已有mTOR抑制剂可用于治疗RCC。在近代之前,所有ESC-RCC病例均为成年女性患者,通常表现为低分期、单侧肿瘤,预后良好,无复发或转移证据。Sakhadeo等开展了一项病例系列研究,其中3例患者中有2例(均为女性)出现转移性疾病。1例出现肝转移,另1例出现腹主动脉旁淋巴结和骨转移。这些发现为这些肿瘤的侵袭性和转移倾向提供了越来越多的证据。目前,ESC-RCC的转移率估计为3% ~ 5% ;然而,精确的预后和转移潜能仍有待定论,因为只有有限的报道记录了转移。通过这些记录在案的伴有转移性疾病的ESC-RCC罕见病例,证明了一项研究将该实体命名为“肾细胞癌”是合理的,强调了对这些患者进行持续临床随访和监测的必要性。
讨 论
嗜酸性实性和囊性肾细胞癌是2022年发布的WHO肾肿瘤分类中最近引入的一种新类型。具有其所有形态学特征的肿瘤被称为“未分类”、“颗粒性嗜酸性癌”或“嗜酸性大囊性癌”。Trpkov等人于2016年首次提出ESC-RCC的名称,认为是TSC相关RCC。后来,ESC-RCC在非综合征患者中被描述,到目前为止,已知约90%的病例是散发的。然而,TSC1/TSC2基因的功能缺失在散发性ESC-RCC中非常常见;因此,ESC-RCC被认为潜在提示TSC基因突变。
已知本文中的患者有动脉高血压,无TSC的其他临床表现。虽然本文患者未被诊断为TSC综合征,但进行的分子研究显示TSC1基因突变。这一发现与文献中的数据相吻合,证实了大多数ESC-RCC病例是散发的,ESC-RCC是存在TSC1/TSC2突变的良好预测指标。ESC-RCC好发于女性,发病年龄多样,包括儿童患者,平均发病年龄57岁。大体上,肿瘤的大小也不同,大多数较小,小于5 cm,大多数肿瘤在pT1期(小于4 cm)诊断。在本文病例中,患者是一名58岁的男性,有一个最大直径为12 cm的孤立性肿瘤。肿瘤同时浸润肝门部脂肪组织,分期为pT3a期。这些流行病学和宏观特征代表了该中年男性ESC-RCC病例的特殊性,伴有异常大的肿瘤和晚期的TNM分期。在临床表现方面,ESC-RCC被描述为一种无症状的疾病,无明显的体征或症状,通常偶然发现。在本文病例中,患者就诊于泌尿外科,肉眼血尿是单独的主要症状。本文病例也符合文献中描述的典型形态,实性和囊性结构,胞质丰富的嗜酸性颗粒和嗜碱性颗粒,囊腔内衬鞋钉细胞。本病例的独特性在于存在广泛的出血和坏死区域,以及肿瘤对肝门脂肪组织的浸润。
本病例的免疫组化特征是ESC-RCC特异性的,PAX8呈强弥漫阳性,CK20、CD10和AMACR呈局灶性阳性。虽然仅CK20局灶阳性,而CK7、CD117和黑色素细胞标志物均阴性,使我们离最终诊断又近了一步。在本文病例中,文献中描述的免疫组织化学特征没有差异,再次证明了免疫组织化学在病理中的重要性。
分子研究显示TSC1突变,证实了研究者对ESC-RCC的推定诊断。因此可以得出结论,ESC-RCC与TSC1/2基因突变的存在有很强的相关性,尽管这种特殊类型的肾细胞癌的分子特征需要进一步研究。
总之,ESC-RCC是一种罕见的肿瘤,具有独特的形态学、免疫组织化学特征和分子特征,在新的WHO 2022分类中已明确定义为一个实体。这篇文章总结了现有的关于ESC-RCC的数据和知识,并介绍了一例病例,旨在促进医学文献,并提供对这种罕见疾病的理解。本病例的特殊性在于发生在中年男性ESC-RCC患者,伴有异常大的肿瘤,存在广泛的坏死和出血区域,且TNM分期较晚。希望随着新的研究的发表,ESC-RCC的诊断数量将增加,这将有助于病理学家提高他们对ESC-RCC的认识。
参考文献:
Loghin, A.; Popelea, M.C.; Todea-Moga, C.D.; Cocuz, I.G.; Borda, A. Eosinophilic Solid and Cystic Renal Cell Carcinoma—A Case Report and Literature Review. Int. J. Mol. Sci. 2024, 25, 5982. https://doi.org/10.3390/ijms25115982返回搜狐,查看更多
责任编辑: