

转自:安必平
本次精讲病例来源宁波市临床病理诊断中心赵明教授。
女性,51岁,左肾2.3cm占位。
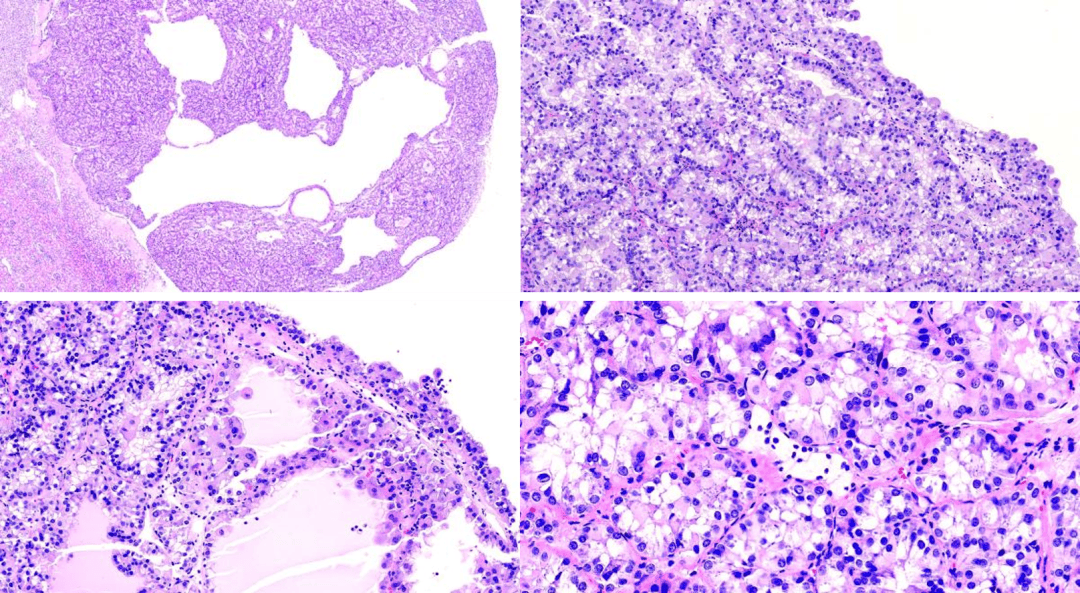
形态学:肿瘤边界清晰,无包膜,呈实性和囊性外观,实性成分为主,囊性成分较少;肿瘤实性肿瘤细胞呈腺泡状/乳头状排列,肿瘤细胞胞浆以嗜酸性为主,可见透明胞浆;在囊性区域衬覆上皮呈靴钉样,胞浆丰富嗜酸,可见大汗腺样化生细胞的特点;高倍镜下肿瘤腺泡嗜酸性胞浆中有嗜碱性点彩状颗粒,细胞核可偏位。

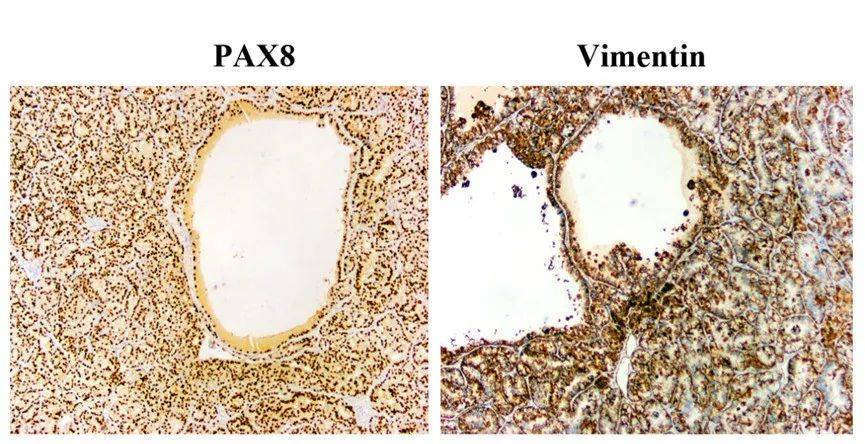
免疫组化:PAX8阳性,Vimentin阳性,说明是近端肾单位起源的肿瘤。
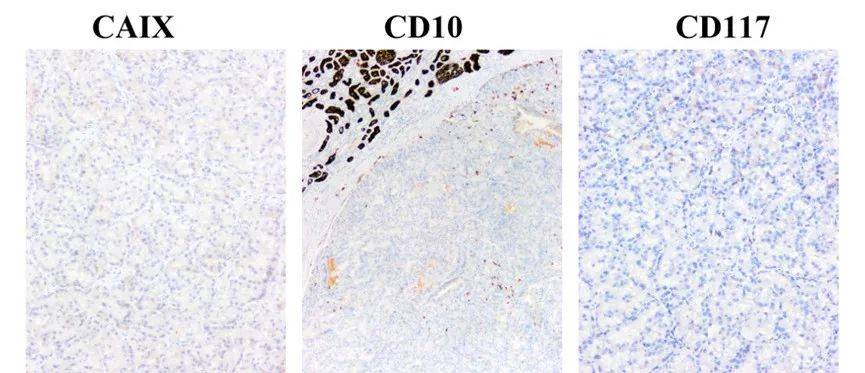
CAIX、CD10、CD117阴性,排除透明细胞癌高级别、嫌色细胞癌和嗜酸细胞瘤。
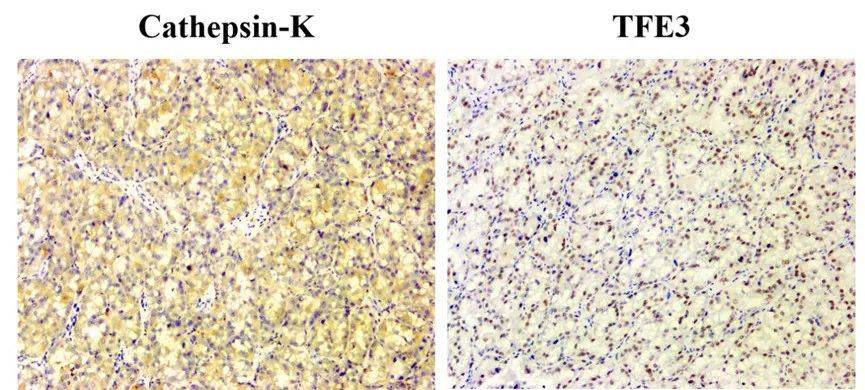
Cathepsin-K染色弱,背景也有着色无法判断,TFE3染色弱,背景有轻微着色,TFE3阳性结果不确定。
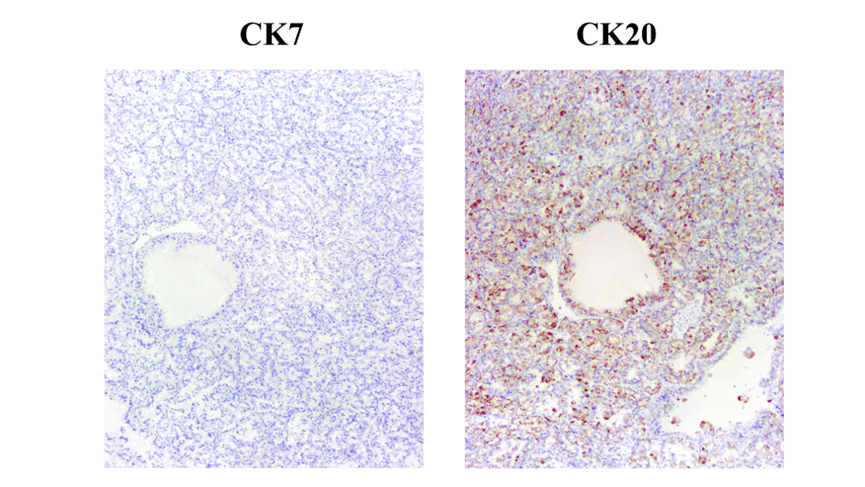
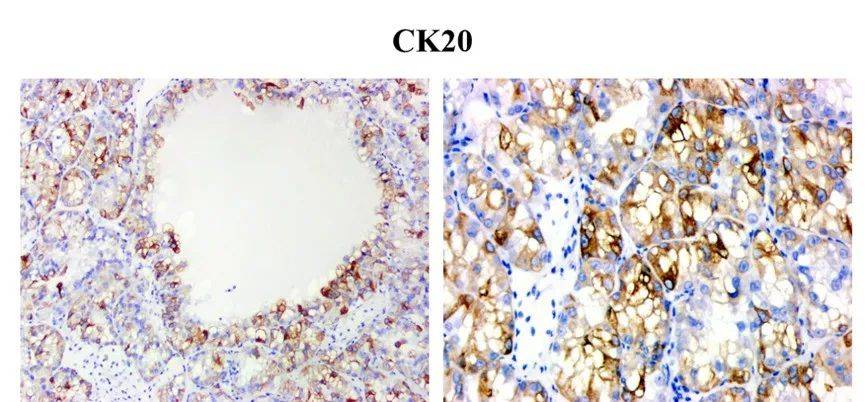
CK7 阴性,CK20斑驳状阳性,嗜酸性实性囊肾细胞癌中CK7可弥漫-斑片状-局灶阳性;在嗜酸性细胞瘤和嫌色肾细胞癌中CK20是弱的膜表达,需要注意!
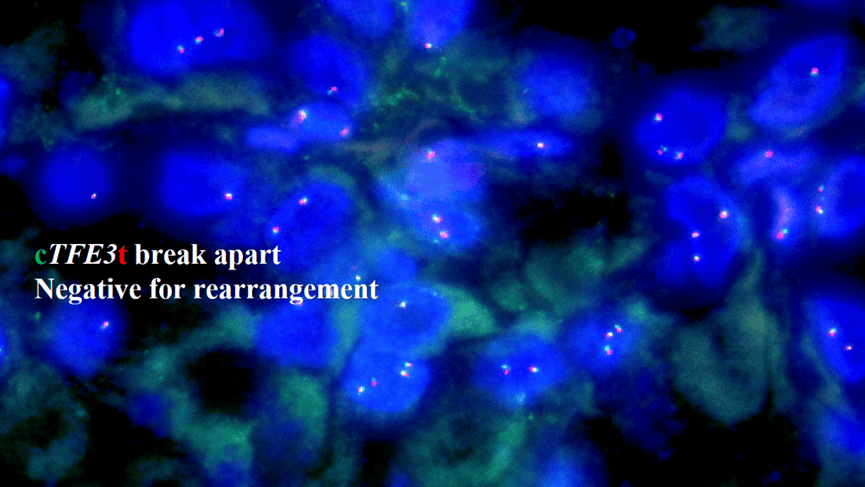
FISH:TFE3断裂阴性。
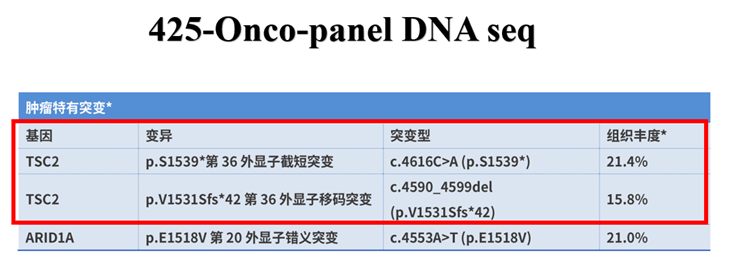
DNA-seq:TSC2基因突变。

结合肿瘤大体、组织学形态、免疫组化及分子改变,该病例最终诊断为嗜酸性实性囊性肾细胞癌(Eosinophilic solid and cystic renal cell carcinoma,ESC RCC),ESC RCC常伴有TSC突变;当Vimentin阳性应注意是近端肾单位起源肿瘤,更易发生转移;对于未能确定是瘤或癌的病例时应注意Vimentin抗体表达情况。
文献一

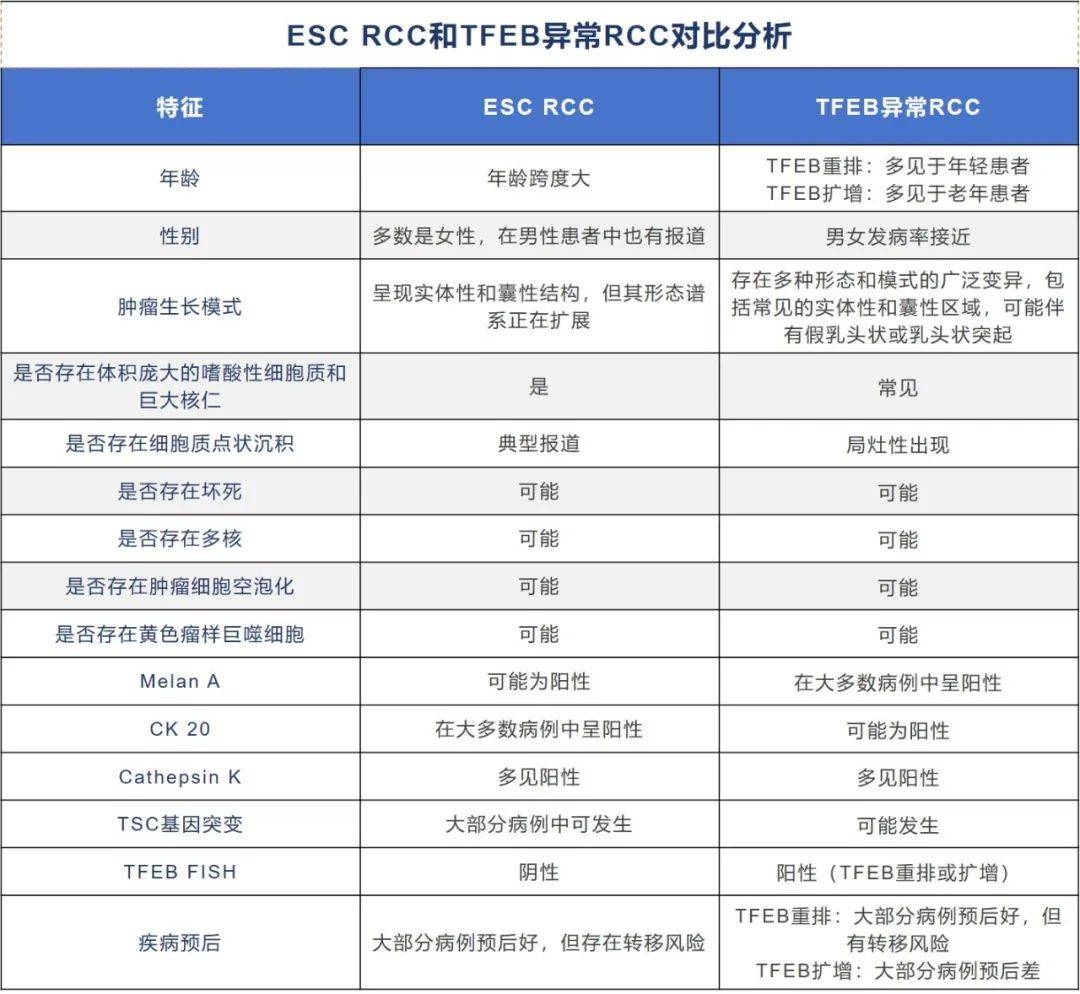
该研究针对6例ESC RCC和4例伴TFEB异常RCC进行病理特征对比;在ESC RCC发病人群中年龄跨度大(6-83岁),所有病例肿瘤大体均显示肿瘤边界清晰,切面呈黄色,并伴有坏死和出血。通过肾切除术成功治疗,一例TFEB扩增的RCC出现脑转移。从组织学上看,所有肿瘤均显示出具有丰富细胞、颗粒状嗜酸性胞质和具有显著核仁的圆形细胞核的区域,且10例中的8例显示实性和囊性区域的混合。免疫组化方面,所有肿瘤均为PAX8和GPNMB阳性。所有ESC RCC病例在TFE3和TFEB FISH检测中为阴性,在剩余的4例RCC中,TFEB FISH为阳性;所有病例均显示CK20阳性,CK7仅在单个细胞中呈阴性或阳性;有5/6例ESC RCC和4/4例TFEB异常的RCC中Melan A表达阳性。所有ESC RCC的MIB-1增殖指数均小于20%,而在四例TFEB异常RCC中,有三例高于20%。在NGS检测中,在2/5例ESC RCC和1例TFEB异常病例中检测出TSC基因突变。在文献当中,包括本研究中ESC RCC病例表现低级别肿瘤特征,在大多数病例报道中ESC RCC呈现预后好的趋势,TFEB扩增RCC预后与之相反,疾病发展预后不佳并且可发生远端转移现象。总的来说,准确区分ESC RCC与TFEB异常RCC对于患者预后判断尤为重要,在本研究中ESC RCC和TFEB异常RCC拥有相近的组织学特征,在免疫组化上同样表达CK20和Melan A,分子检测中可以发生TSC基因突变;以及可通过FISH检测TFEB基因状态区分病例。
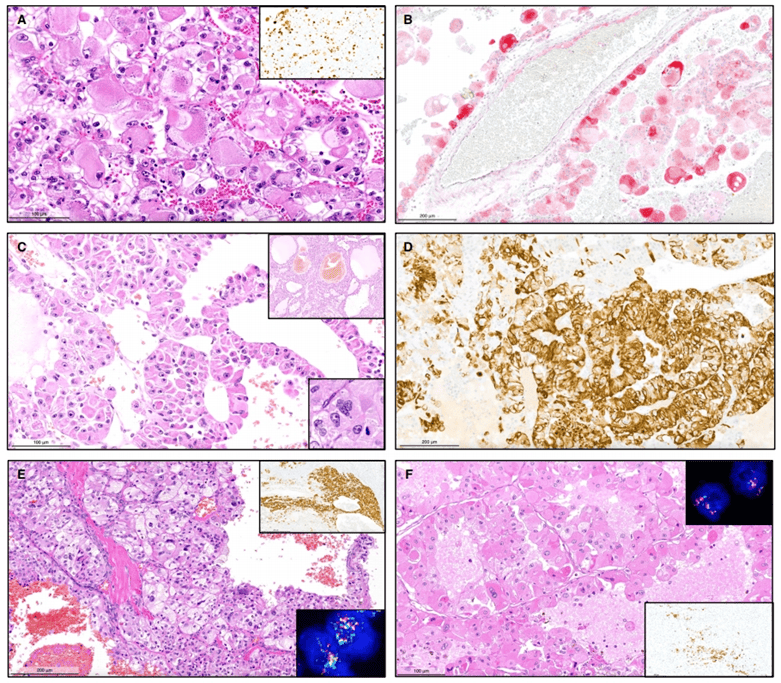
ESC RCC(A和B图)和TFEB异常RCC(C、D、E和F图)病例组织学特征
文献二

病例一
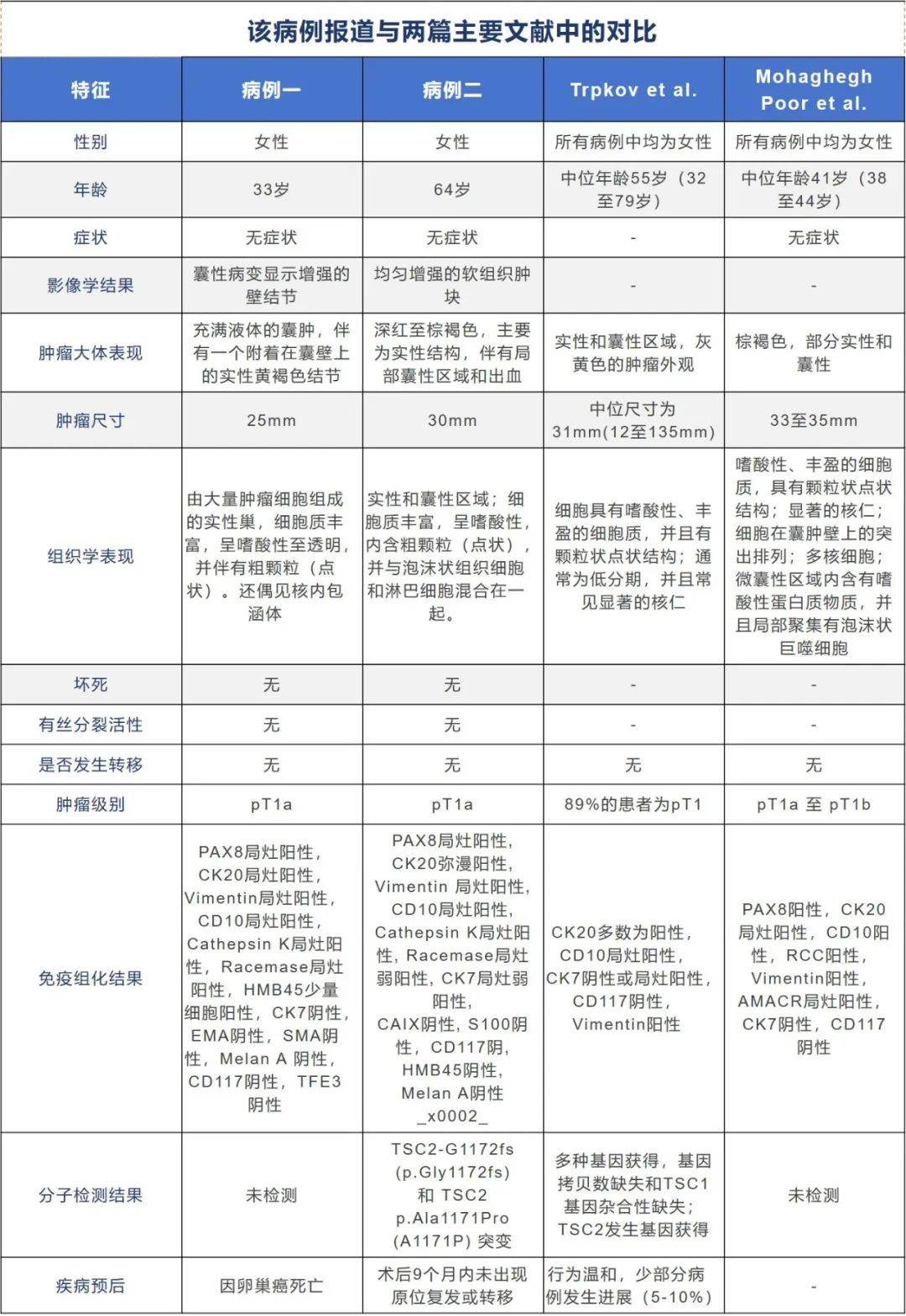
患者为33岁女性,有卵巢癌病史;腹部超声显示右肾肿块,MRI显示右肾前极区内有一个囊性病变,直径可达2.7cm,并伴有增强的壁结节。部分肾切除术后,发现一个尺寸2.5×2.4×1.9cm的囊肿。肿瘤大体显示,一个1.6×1.0×0.5cm的黄褐色结节附着于囊壁;组织学检查显示,结节由大量肿瘤细胞的实性巢组成,这些细胞具有丰富的嗜酸性至透明的细胞质,在细胞质中有粗颗粒(点状)结构,偶见核内包涵体,未见坏死或显著的有丝分裂活性。免疫组化显示肿瘤细胞PAX8,CK20,Vimentin,CD10,Cathepsin K和Racemase为局灶阳性,HMB45在少量肿瘤细胞中为阳性。肿瘤细胞的CK7,EMA,c-kit,SMA,Melan-A和TFE3为阴性;并未进行下一步分子检测;患者最终因卵巢癌离世。
病例二
患者为64岁女性,有胸主动脉瘤、扩张型心肌病和慢性心力衰竭病史;CT显示其左肾有一个在两年内从2cm增大至4cm的肿物,病理切片结果显示倾向ESC RCC的诊断;随后进行的部分肾切除术显示,在左肾上极有一个大小为3.0×2.5×1.8厘米的边界清晰的软性病变。连续切片显示出一个深红至棕褐色的肿块,主要为实性结构,伴有局部囊性区域和出血。组织学结果显示,肿瘤区域出现实性和囊性结构;肿瘤细胞具有大量嗜酸性细胞质,并且细胞质内可见粗颗粒(点状结构)。这些肿瘤细胞与泡沫状组织细胞和淋巴细胞混杂在一起。免疫组化结果为PAX8和CK20为强阳性,Vimentin、CD10和CK7为局灶阳性,Racemase和CK7为局灶弱阳性,CAIX,S100,MelanA,HMB45以及CD117为阴性。二代测序结果为发生TSC2 p.Gly1172fs (G1172fs) 和 TSC2 p.Ala1171Pro (A1171P)突变,对比正常肾脏实质测序结果,没有其他驱动RCC相关突变以及基因拷贝数无异常。
文献中另外引用了两篇ESC RCC病例报道,并将其与本次病例报道进行对比;指出在另外两篇病例报道中包含儿童和成年患者,测序结果显示发生相互排斥的TSC1或TSC2突变。因此提出TSC1/2应是ESC RCC标志性分子靶点;另外,曾有文献报道一例青年女性ESC RCC对依维莫司(mTOR抑制剂)有完全响应的病例。在ESC RCC病例中准确辨别TSC1/2突变对于术后预后不良或肿瘤进展快速的患者可提供多种治疗方案选择。
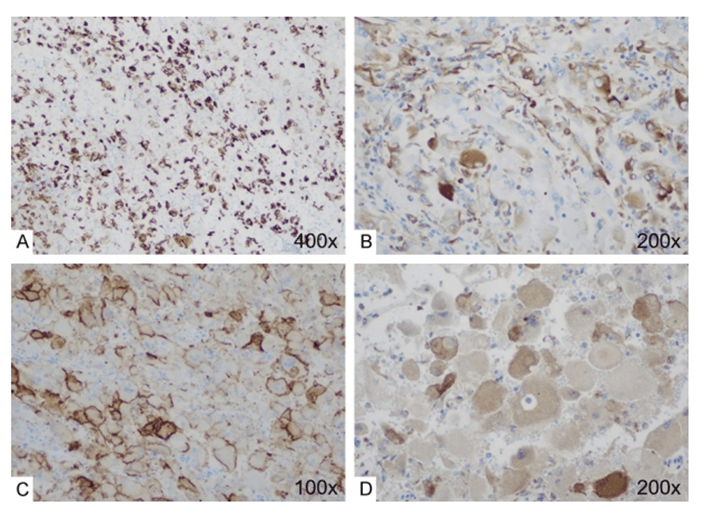
病例二 免疫组化显示肿瘤细胞中CK20(弥漫强阳性,A图),Vimentin(局灶阳性,B图),CD10(局灶阳性,C图),Cathepsin K (局灶阳性,D图)
通过上述赵明教授的病例分享以及相关文献报道,可以了解到ESC RCC具有独特的组织学形态(囊实性,大量嗜酸性胞质和粗糙的嗜碱性颗粒)、免疫表型(CK20和组织蛋白酶K阳性)及分子改变(TSC1/2/mTOR突变),与TFEB异常RCC具有显著的病理差异;ESC RCC属于罕见且诊断较为困难的疾病,病理诊断上可应用组织学,免疫表型以及分子平台如FISH 检测TFEB重排或二代测序检测TSC1/2基因突变进行鉴别诊断。尽管大多数ESC RCC的患者病情进展缓慢,但仍有部分病例报道其表现出侵袭性行为,了解ESC RCC肿瘤实体及其特征性细胞形态、免疫表型以及分子改变,将有助于在活检样本中给予充分提示;这些分子特征的发现在未来可能为制定新的治疗策略提供更多依据。
向上滑动阅览
相关文献
[1] Lobo J, Rechsteiner M, Helmchen BM, Rupp NJ, Weber A, Moch H. Eosinophilic solid and cystic renal cell carcinoma and renal cell carcinomas with TFEB alterations: a comparative study. Histopathology. 2022 Jul;81(1):32-43. doi: 10.1111/his.14663. Epub 2022 May 4. PMID: 35403742.
[2] Yin J, Zenezan D, Doan KD, Nobee A, Wei S, Mollaee M, Proca DM. Radiologic and clinicopathologic features of eosinophilic solid and cystic renal cell carcinoma: report of two cases and review of literature. Int J Clin Exp Pathol. 2023 Oct 15;16(10):303-308. PMID: 37970333; PMCID: PMC10641369.
[3] Cao HH, Li H, Guo XH, Cao ZX, Zhang BH. Eosinophilic solid and cystic renal cell carcinoma with aggressive behavior: Two case reports. World J Clin Cases. 2024 Aug 6;12(22):5124-5130. doi: 10.12998/wjcc.v12.i22.5124. PMID: 39109003; PMCID: PMC11238771.
(转自:安必平)返回搜狐,查看更多
责任编辑: